【健康醫療網/記者鄭宜芬報導】國民黨立委王鴻薇17日質疑,高端流感疫苗臨床試驗只針對20至50歲進行試驗,原液製造的韓國GC公司又以機密理由拒公開疫苗資料,如何取信於民眾?食品藥物管理署副署長陳惠芳表示,南韓GC公司臨床試驗收案3歲以上個案,且有亞洲族群數據,因此台灣銜接性試驗認為無族群差異疑慮;其他流感疫苗如GSK試驗僅含括18歲以上台灣人,東洋流感疫苗則未在國內進行臨床試驗。
陳惠芳表示,台灣的疫苗審查都依照ICHE5(國際醫藥法規協和會)的銜接性試驗基準,審視療效及安全性。「高端四價流感疫苗」南韓GC原廠有針對3至18歲、19歲以上、65歲以上民眾進行三期臨床試驗,接著於我國執行20至50歲民眾第三期臨床試驗。綜合韓國及台灣臨床試驗結果,無族群差異的疑慮。
高端疫苗在韓國製造,相關臨床試驗也是在韓國進行。陳惠芳表示,疫苗臨床試驗並不會限制在哪執行,可減少重複作業,只要求一定要有亞洲族群的臨床試驗數據。其他已核准之流感疫苗,GSK流感疫苗第三期也僅納入18歲以上台灣人,東洋未在國內執行臨床試驗,賽諾菲在多國多中心臨床試驗中有涵蓋台灣,國光則都在台灣製造、生產。
我國核准之四價流感疫苗資訊表列
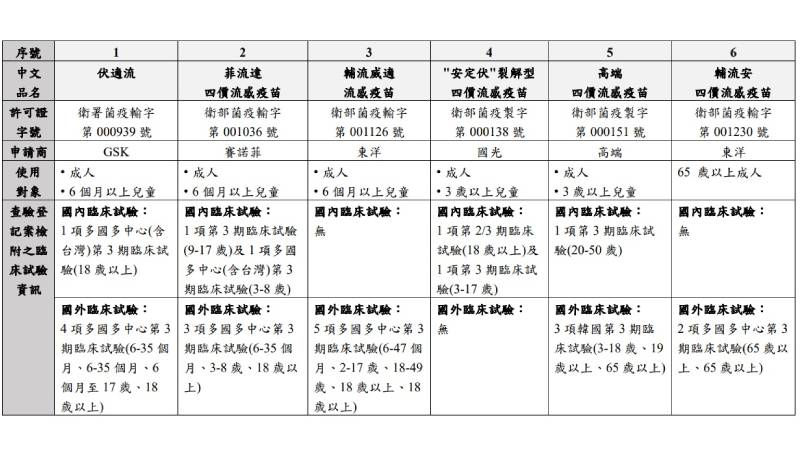
▲我國核准之四價流感疫苗資訊表列。(圖/食藥署提供)
廠商資料不能公開? 食藥署:依藥事法保密
至於廠商數據文件不予公開,陳惠芳表示,依據藥事法40條之1、營業秘密法,藥品查驗登記時所檢附原始數據屬營業秘密之資料,不能對外提供,「否則沒有廠商想要將資料送審給台灣」。
另藥品查驗登記所檢附之臨床試驗相關資訊,會刊載於核准仿單第8節「副作用/不良反應」及第12節「臨床試驗資料」段落,可於食藥署官網「西藥、醫療器材、化粧品許可證查詢系統」查詢。
食藥署強調,依規定針對四價流感疫苗製程管控、藥毒理試驗及臨床試驗結果進行嚴謹審查,確認其品質、安全及有效性後,才能核發藥品許可證。且逐批疫苗放行前,須經食藥署檢驗封緘,檢驗項目包括:進行外觀、鑑別、效價、無菌、異常毒性、不活化、甲醛、pH值、卵蛋白含量(細胞製程流感疫苗則檢驗DNA含量)、蛋白質含量及細菌內毒素等10至11項檢驗,經檢驗封緘合格放行後,才會供國人接種。
高端方面表示,遵守我國「藥事法」第40-1條規定,其營業秘密資料受到法律保護。且WHO PQ(世界衛生組織藥品供應商資格預認證)也無要求GC流感疫苗在流通的63國家重複相同的臨床試驗[i]。GC流感疫苗臨床試驗數據已刊載於仿單,可參閱WHO[ii]及台灣衛生福利部網站[iii]。