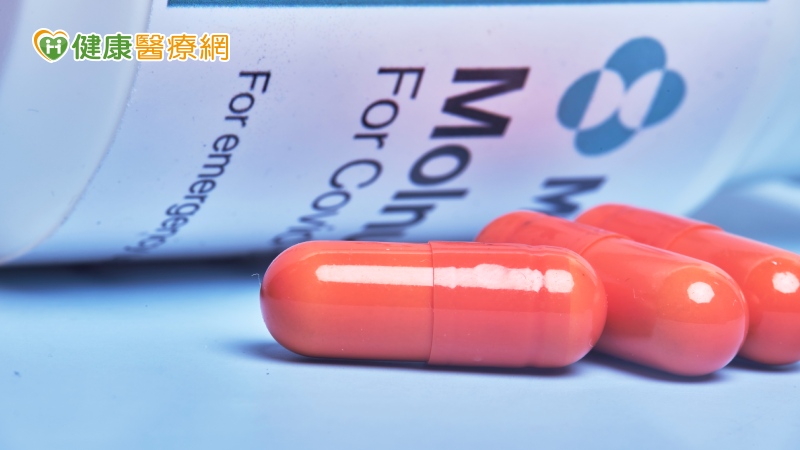
【健康醫療網/記者賴欣平報導】因應來勢洶洶的新冠肺炎Omicron變種病毒株,去(2021)年12月23日美商默沙東藥廠推出的「新冠病毒口服藥Molnupiravir」,通過美國FDA緊急使用授權EUA。默沙東藥廠全球醫藥事務處SVP(Senior Vice President)Eliav Barr博士說:「Omicron與其他新冠肺炎病毒株相異處在於棘蛋白,而我們的口服藥物作用在新冠病毒其他部分,所以可以樂觀的表示,此藥對於Omicron也有一定的幫助。」根據研究結果顯示,Molnupiravir協助降低新冠肺炎重症高風險之成人確診者30%的住院率及死亡率。
新冠肺炎口服藥 通過食藥署專案輸入及EUA
衛生福利部食品藥物管理署(以下簡稱食藥署)為積極因應新冠病毒(COVID-19)防疫需求,於今(2022)年1月8日邀請國內化學製造管制、藥學、毒理學、臨床醫學等領域專家召開會議,討論美商默沙東藥廠股份有限公司台灣分公司的COVID-19口服抗病毒藥品Molnupiravir專案輸入申請案。
而食藥署1月11日證實,經評估Molnupiravir的療效、安全性及使用的風險效益,例如不使用該藥物的情況下,疾病轉重症或死亡率概率為何,使用後可能產生之風險,並考量國內緊急公共衛生需求,由這幾方面下去權衡後,與會專家建議依據藥事法第48條之2規定,同意核准此藥專案輸入及緊急使用授權EUA。
重症高風險之成人確診者專用 注意事項搶先看!
新冠病毒口服藥主要目的,在於降低重症高風險族群確診後轉變為重症之機率,並非用來預防染疫,也不是所有確診者都建議使用。此藥適應症包含:(1)仍在發病5日內(2)具有重症風險因子,如60歲以上年長者、糖尿病、肥胖(BMI≥30)、慢性腎病、嚴重心臟病、慢性阻塞性肺病及癌症等(3)臨床上不適用其他治療之輕、中度新冠肺炎成人確診者。
而藥物何時進口,何時可開始用,食藥署回應,仍需待指揮中心統一說明,但就此藥使用方式,食藥署藥品組林意筑專門委員提醒民眾以下幾點注意事項:
(1)如確診新冠肺炎,發病5日內即需使用口服藥,並且應確實完成5天之完整療程,不可擅自停藥。
(2)治療期間及治療後,需配合指揮中心的隔離政策,才能有效降低新冠肺炎的傳播率。
此外,食藥署強調,廠商也應於專案核准輸入期間執行風險管理計畫,以保障病人用藥安全。
參考資料來源:
《CNN》FDA authorizes second antiviral pill to treat Covid-19