藥華藥(6446)今(15)日受邀參加法說會,說明2024第三季財報、近期營運重點及未來展望。
2024第三季財報重點
藥華藥第三季營收27.1億元,季增17.52%,年增107.50%,成長幅度大躍升,自2023年第二季起已連續六季度創新高。第三季本業獲利達7.3億元,季增65.98%,較去年同期增加13.8億元;第三季淨利達7.2億元,季增5.86%,年增263%;基本每股盈餘(EPS)達 2.21元,三項指標均創新高。繼今年第一季首次達成單季本業獲利的里程碑後,第二季本業獲利季增24倍,第三季成長力道仍然強勁,季增達近66%。
藥華藥旗下治療真性紅血球增多症(PV)新藥Ropeginterferon alfa-2b(簡稱Ropeg, 即P1101)全球銷售持續成長。值得關注的是,相較第三季營收季增17.52%,第三季的費用僅季增5.59%,更較去年同期降低9.76%,主要為適當控管管理及銷售費用。
藥華藥前三季累計營收66.7億元,年增92.94%;同時在嚴謹管控費用的努力下,費用較去年同期減少4.59%。前三季本業獲利大幅度成長到11.9億元,較去年同期增加29.8億元;前三季淨利達17.3億元,已賺半個股本,較去年同期增加24.7億元;EPS則達5.23元。充分突顯新藥公司業績的爆發力,以及高獲利能力。
公司表示,營收及獲利均呈成長趨勢,並維持高毛利率。以目前趨勢,營收有望持續維持逐季成長;再配合控管營運支出,在嚴謹管控費用且銷售能力提升下,獲利表現將會愈來愈佳。
藥華藥本月5日公告10月營收9.1億元,年增67.02%,維持強勁年成長率。今年累計至10月營收已達75.9億元,年增89.40%。
近期營運重點:隨全球營運規模擴大獲利快速成長
美國市場方面,銷售持續成長。在新領導團隊的帶領下,開立Ropeg處方的新醫師及用藥患者人數持續加速增加,效率大幅提升。另外,美國子公司已啟動大數據商業數據分析,並持續以AI運算平台輔助業務推廣,預期Ropeg在美國的覆蓋率將持續攀升。
日本市場方面,銷售亦持續成長。公司表示,以Ropeg快速遞增劑量方案(250-350-500mcg)進行的PV臨床試驗已完成,全程沒有受試者停止用藥,且初步數據與以相同給藥方案進行的中國PV第二期臨床試驗結果一致,顯示Ropeg的快速遞增劑量方案非常有效且耐受。預計明年將向日本PMDA申請修改目前仿單,進一步推動高劑量Ropeg的使用,擴大Ropeg日本市場。
藥華藥表示,日本醫病關係非常密切,患者停止用藥的比例十分低,加上藥華藥日本團隊持續進行病患支持的服務、尋找PV潛在患者,並積極推動患者進行JAK2突變基因的檢測,有助於病人長期使用Ropeg,並用到高劑量。
Ropeg於2024年6月1日在日本上市滿一年,獲日本健保給付患者自行施打,並放寬處方天數,一次最多可以拿取90天藥量,大幅提升病人用藥意願。日本團隊於10月1日進一步推出藥品宅配服務,便利患者取得藥品,這項新服務開始逐漸發酵,促進提升使用Ropeg的病人數,推升日本營收持續增長。
中國市場方面,Ropeg於6月28日獲中國藥監局核准用於PV,為第一且唯一獲中國核准用於PV藥物。因中國醫保藥價偏低,公司目前將先聚焦在中國各大醫院進行Ropeg的自費銷售,並將持續洽談適合的銷售合作對象。
未來展望:獲利成長與創新研發並進持續擴大研發能量
照計畫力拚新藥研發 增加Ropeg新適應症
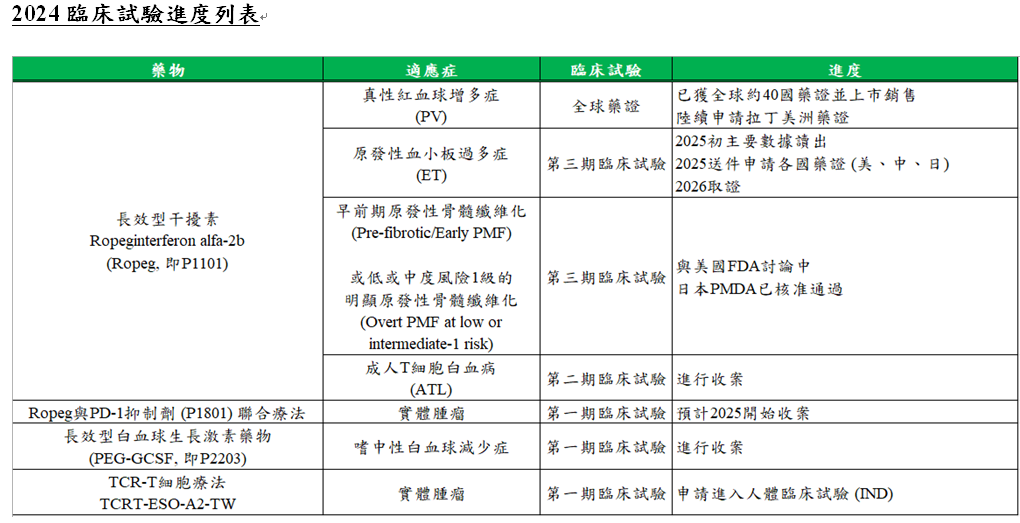
有關擴展Ropeg新適應症進度,用於原發性血小板過多症(ET)的全球第三期臨床試驗(SURPASSET)共收入174個 ET患者,最後一位受試者已於11月12日完成試驗(LPLV),公司預計明年年初取得並公布評估指標之統計結果。藥華藥表示,預計2025年開始申請各國藥證,包括美國、中國及日本等國,2026年取證,現正投入行銷前準備。
而Ropeg用於早前期原發性骨髓纖維化(Pre-fibrotic/Early PMF)或低或中度風險1級的明顯原發性骨髓纖維化(Overt PMF at low or intermediate-1 risk according to DIPSS Plus)的全球第三期臨床試驗(HOPE-PMF),目前正在與美國FDA討論中,日本PMDA則已核准通過。
另外,公司也已與全球頂尖的醫療機構及合作夥伴攜手進行研究者自行發起之臨床試驗(investigator-initiated trial, IIT),持續擴展Ropeg用於更多新適應症,造福更多患者。
其他臨床試驗進度
Ropeg於美國及加拿大進行的兩項臨床試驗─ECLIPSE PV和EXCEEDET已收案完成,最終收案人數分別高達收案目標的111%及142%,顯示臨床研究機構對Ropeg顯著療效和安全性的高度關注。
ECLIPSEPV是一項第3b期臨床試驗,評估Ropeg的兩種給藥方案(Ropeg的快速遞增劑量方案(250-350-500mcg)對照目前仿單建議的給藥方案)用於成人PV患者的有效性和安全性,最終收案人數達到111人,超過原訂目標的100人,達111%,預計將有助於高劑量Ropeg的推廣。
EXCEEDET則是一項第2b期無對照組之單臂臨床試驗,以Ropeg的快速遞增劑量方案(250-350-500mcg)評估Ropeg用於ET患者的有效性和安全性,最終收案人數達到91人,超過原訂目標的64人,高達142%,預計將有助於Ropeg的ET藥證申請。
Ropeg以外的新藥臨床試驗進度亦進展順利,藥華藥旗下長效型顆粒性白血球生成素(PEG-GCSF, 研發代號P2203)在台灣進行的第一期臨床試驗已開始收案,PD-1抑制劑P1801接續Ropeg,兩者搭配用於治療末期腫瘤患者之第一期臨床試驗也已獲TFDA同意執行,預計2025年初開始收案。
近年來,實體腫瘤治療已漸成為細胞療法的主流,尤其是技術和成本上存在高門檻之T細胞受體(TCR-T)免疫療法尤為受到關注。藥華藥在四年前即放眼細胞療法領域,積極參與並投入相關人才培育及臨床試驗準備,並在南港國家生技園區的實驗室建置研發基地。公司於11月2日正式向衛福部食藥署(TFDA)申請進行TCRT-ESO-A2-TW用於治療末期實體腫瘤患者的第一期臨床試驗(IND),標誌藥華藥跨足細胞療法領域達到的重要里程碑。
擴大研發能量
藥華藥持續創新研發,為擴大研發能量及發展多元產品線,藥華藥台北研發中心據點自南港軟體園區的13樓擴充至18樓和19樓;同時,更進一步擴充至國家生技園區及台北生技園區,未來可成為進行細胞療法與生物藥研發、試製及GMP生產的廠房。
位於波士頓的創新研發中心(PIRC)著重開發同類最優(Best in Class, BiC)和同類第一(First in Class, FiC)療法、積極發掘策略合作夥伴,持續主動探索創新研發項目以拓展產品線,並持續運用公司Pegylation核心技術平台創新研發,結合其他細胞激素發展更多長效型蛋白質藥物,如創新長效型介白素(PEG-IL2, 研發代號P11838)科專補助的申請已在複審中,預計2025年底至2026年初申請進入人體臨床試驗(IND),有望成為BiC新藥。
PIRC也正進行新的抗體偶聯藥物(Antibody Drug Conjugate, ADC)和雙特異性抗體藥物(Bispecific Antibody, BsAb)研發項目,目前均已有候選藥物,積極準備進入臨床試驗。
全球供應鏈進度
藥華藥台中廠第二條產線擴建完成,製程確效已近完成,準備向美國及歐盟提出廠證申請,產能倍增可供應2萬多病患。。此外,為擴充產能,竹北廠工程持續順利進行中,依原定計畫推進2026投產,產能可供應全球超過10餘萬名病患。