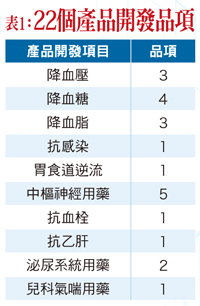
法德生技藥品股份有限公司(4191)是由一支擁有口服固體緩控釋製劑產品開發專業的團隊所組成,主要開發領域為美國第四類特殊學名藥(Abbreviated New Drug Application,ANDA),有豐富且完整的成功實戰經驗。除設立台灣總公司外,另設有大陸子公司、美國子公司和歐洲子公司。台灣總公司設置有營運總部與研發中心,營運總部負責統籌與推動集團業務以及監管各子公司運作,以利研發技術團隊能在國內長期發展優勢與競爭,再說,法德認為國內擁有許多相關經驗的專家,長期投入之條件是很合適且充分的。法德布局歐、美、大陸市場多年美國子公司為專門負責美國境內各業務推廣,並且負責所有與FDA(Food and Drug Administration)往來業務。歐洲子公司如同美國子公司的營運概念,以歐洲相關藥政單位為對象進行往來業務。大陸子公司設有符合美國FDA的cGMP藥廠,專責法德藥品的製造生產。法德初期即以全球進入門檻最高的美國學名藥市場為發展主力,法德憑藉著通過美國FDA產品上市核可的成功光環,積極布局於市場規模巨大的中國大陸藥品市場,在搶攻商機之下,朝著成為全球性學名藥大廠邁進。法德生技藥品董事長黃逸斌表示,中國是繼歐美之後很大的市場,也是未來前進全球化的主要市場,如何以長遠目光捷足先登在中國埋下布局種子,是極為值得探討的,而這些過程都是有故事的。藥改為立足大陸市場之契機大陸在去(二○一五)年七月二十二日公布藥改(詳見小百科一),將法規與美國FDA直接結合,爾後也大刀闊斧並毫無猶豫的強力去執行,甚至連大廠都被抓出來開刀。黃逸斌表示,過去大陸在製藥產業上的環境比較混亂,而藥改表面上看似是改善生產藥品品質的問題,但實際上的最終目標是希望製藥產業能夠與國際接軌,且不只是要做製藥產業的大國,還要成為製藥產業的強國。雖然在公布前就有傳出風聲,但是大家都認為不可能會把所有利益結構全部摧毀,直到十二月二日公告整個藥改主體,大家才知道是玩真的。法德過去依照FDA標準去做,具備所有相關數據之證明,固然在大陸市場混亂的情形下能不被藥改動作所淘汰,此立足點更成為布局大陸的一大機會。去年年初,法德將降血壓藥送至大陸藥監局並耗費十一個月做完審查,正準備送往大陸國家局時,藥監局建議法德先行觀望等新法出來,之後,法德便因新法而順勢將產品送入優先審批,最快二○一八年就能拿到藥證。藥改推出「一致性評價」,只要藥品符合「一致性評價」就能優先審批,如果有一家廠商通過優先審批,就能被醫院優先採購;如果同一品種有三家廠商通過,醫院就只能跟這三家購買,所以,搶到優先審批就能擁有寡占市場,並且還會有比較好的藥價。在過去,廠商是以參比原廠製劑跟仿製藥一起做BE(生體相等性試驗,詳見小百科二),經過統計計算與原廠一樣即可申請製作,而為了爭取較高的醫保價格,仿製藥廠商會去改原廠劑量、劑型、包裝,比如新劑量藥等,但是,不同劑量卻不能有效證明有臨床效果,加上參比製劑可能是自己編的,所以藥改推出「一致性評價」,要求劑量相同或者是能有效證明本身具有臨床效果才能優先審查,並且還能防止做假報告的狀況發生。另外,在做BE前要先向CFDA(大陸之國家食品藥品監督管理總局)申請臨床批文,但是,光是申請批文就要排隊排四到五年,等到做完BE把數據整理好送去CFDA做審查,審查完才進入到生產批文的申請,這兩段程序下來幾乎需要七、八年,對於國外學名藥來說一點經濟效益都沒有,更是歐美廠商不願進入的市場,而藥改推出的「一致性評價」即能加速審查,在備案完且一個月內沒有問題就能夠執行BE試驗,並且,如果符合美國FDA標準或者生產線有向歐美等先進國家申請,即能用「中美雙報」去加速審查,這些對於擁有FDA標準的法德來說都是一股強勁的契機。法德一步一腳印 規劃市場發展法德在大陸有六千七百平方米的一廠負責FDA產品,也積極建置擁有四萬三平方米的第二廠,基本上的硬體方面都已經建置完畢,其中的中試場則是建置重點,因為藥改准許做報批時,不用做到量產規模要求的十萬單位,只要經過中試場相關試驗就可以進行報批,致使不用先把生產線蓋好即能有計畫地去建設。 在大陸要備案必須先量產十萬單位,並且有很好的配方才能作預試驗,如果預試驗不行就要再重新備案,假設配方設計跟調整能力不夠強就會是一大問題。此外,備案要先找一個臨床基地,通過三甲醫院之倫理委員會。因為大陸進行藥改,所以也不斷執行飛行檢查,導致許多醫院怕出問題而不敢接臨床試驗,但法德本身通過FDA,在面對飛行檢查時不易出問題,加上配方設計是法德的強項,以及過往累積過很多經驗,致使能與南京江蘇省臨床實驗做最好的三甲醫院進行交流,預計在十一月底就可備案,另外,整理完相關資訊並進行報批後,可望明年第一季即能送件。相關獲利方面,法德主要取決於在美國拿到降血壓及精神分裂藥的藥證,預計今年年底到明年第一季有機會拿到FDA藥證,而降血壓藥在美國市場價值一年約為九億美元;精神分裂藥則約為十二億美元。在大陸,降血壓藥則希望在二○一八年上半年推出,另外,許多在美國停止的二十二種產品也可望在未來推出(相關品項詳見表一)。因為目前的大陸法規跟美國接軌,現成做美國外銷與美國FDA廠的價值也隨之提升,加上又能採用「中美雙報」,致使法德現今的廠在經營中國市場是很好的平台。黃逸斌進一步補充,例如糖尿病藥在大陸產量雖然很大,但因為競爭者多所以價格不好,如果走「中美雙報」則可以優先審批並且不用做BE,加上二○一八年年底廠商沒做「一致性評價」就會自動消除藥證,目前整體產量約為五億顆,則法德有望在未來搶進優先審批市場之獨佔商機。董事長帶領法德前進全球化黃逸斌為美國聖約翰大學藥學碩士,過去曾創辦英伯士藥品科技,擁有超過二十五年的豐富生技製藥經驗,除了在領導法德有一套完整的規劃,對於學名藥也有一些看法。黃逸斌表示,學名藥是以培養人才為基礎,如果沒有這個基礎就無法去量產,國內在過去幾年只強調新藥,但是,即使做新藥也還是要量產銷售至全球,並且必須符合國際標準。在看到大陸轉變之下,發現其執行力道很強勁,再加上本身有很大的內需市場,未來很容易就會以雄厚資本把人才吸過去。反過來看,台灣應做扎根才能吸引到更多人才,但現況是,國內人才真正走向產業的很少,這將造成產業空洞且沒有延續性,台灣應該要引以為鑑去思考本質和定位在哪,才不會在產業中迷失方向。未來,法德在產品方面會朝多元化發展以利競爭,如研發貼片等技術性高的產品,除此之外,更會將產品線擴大以利前進全球市場。對法德而言,前進中國布局還只是第一步,未來如何布局於其他歐美國家或者東南亞國家,這些長遠目標都是值得法德一步一步去探討並發展的。
在大陸要備案必須先量產十萬單位,並且有很好的配方才能作預試驗,如果預試驗不行就要再重新備案,假設配方設計跟調整能力不夠強就會是一大問題。此外,備案要先找一個臨床基地,通過三甲醫院之倫理委員會。因為大陸進行藥改,所以也不斷執行飛行檢查,導致許多醫院怕出問題而不敢接臨床試驗,但法德本身通過FDA,在面對飛行檢查時不易出問題,加上配方設計是法德的強項,以及過往累積過很多經驗,致使能與南京江蘇省臨床實驗做最好的三甲醫院進行交流,預計在十一月底就可備案,另外,整理完相關資訊並進行報批後,可望明年第一季即能送件。相關獲利方面,法德主要取決於在美國拿到降血壓及精神分裂藥的藥證,預計今年年底到明年第一季有機會拿到FDA藥證,而降血壓藥在美國市場價值一年約為九億美元;精神分裂藥則約為十二億美元。在大陸,降血壓藥則希望在二○一八年上半年推出,另外,許多在美國停止的二十二種產品也可望在未來推出(相關品項詳見表一)。因為目前的大陸法規跟美國接軌,現成做美國外銷與美國FDA廠的價值也隨之提升,加上又能採用「中美雙報」,致使法德現今的廠在經營中國市場是很好的平台。黃逸斌進一步補充,例如糖尿病藥在大陸產量雖然很大,但因為競爭者多所以價格不好,如果走「中美雙報」則可以優先審批並且不用做BE,加上二○一八年年底廠商沒做「一致性評價」就會自動消除藥證,目前整體產量約為五億顆,則法德有望在未來搶進優先審批市場之獨佔商機。董事長帶領法德前進全球化黃逸斌為美國聖約翰大學藥學碩士,過去曾創辦英伯士藥品科技,擁有超過二十五年的豐富生技製藥經驗,除了在領導法德有一套完整的規劃,對於學名藥也有一些看法。黃逸斌表示,學名藥是以培養人才為基礎,如果沒有這個基礎就無法去量產,國內在過去幾年只強調新藥,但是,即使做新藥也還是要量產銷售至全球,並且必須符合國際標準。在看到大陸轉變之下,發現其執行力道很強勁,再加上本身有很大的內需市場,未來很容易就會以雄厚資本把人才吸過去。反過來看,台灣應做扎根才能吸引到更多人才,但現況是,國內人才真正走向產業的很少,這將造成產業空洞且沒有延續性,台灣應該要引以為鑑去思考本質和定位在哪,才不會在產業中迷失方向。未來,法德在產品方面會朝多元化發展以利競爭,如研發貼片等技術性高的產品,除此之外,更會將產品線擴大以利前進全球市場。對法德而言,前進中國布局還只是第一步,未來如何布局於其他歐美國家或者東南亞國家,這些長遠目標都是值得法德一步一步去探討並發展的。


